4月18日,中國科學院深圳先進技術研究院合成所嚴飛研究員團隊與南華大學附屬長沙中心醫(yī)院陳智毅教授團隊合作的最新成果以“Ultrasound-visible engineered bacteria for tumor chemo-immunotherapy”為題在線發(fā)表于Cell子刊Cell reports medicine。在該工作中,研究團隊構建了一種超聲可視化工程細菌(Ec@DIG-GVs),內部含有聲學報告基因和溫控基因表達線路,表面修飾了阿霉素(DOX)化療藥物。這些工程化的腫瘤靶向細菌可以表達聲學報告基因產(chǎn)生氣體囊泡(GVs),為聚焦超聲(hHIFU)提供實時成像引導,使超聲焦點能精準定位于腫瘤內的工程化細菌,誘導細菌在腫瘤局部表達和分泌IFN-γ。IFN-γ的產(chǎn)生不僅可以殺死腫瘤細胞,還可以誘導巨噬細胞從M2表型向M1表型極化,促進DC細胞成熟。此外,工程化細菌表面的DOX可在腫瘤酸性微環(huán)境中釋放,導致腫瘤細胞免疫原性死亡。IFN-γ和DOX的共同作用激活腫瘤特異性T細胞反應,產(chǎn)生協(xié)同效應大大增強了抗腫瘤的效果。該研究發(fā)展了一種在體可視化調控腫瘤靶向細菌基因表達的新策略,在細菌、免疫細胞、干細胞等活體細胞在體基因表達調控方面具有巨大的潛在應用價值。中國科學院深圳先進技術研究院合成所嚴飛研究員與南華大學附屬長沙中心醫(yī)院陳智毅教授為論文的共同通訊作者。中國科學院深圳先進技術研究院前客座學生楊曜彰為第一作者。

文章上線截圖
原文鏈接:https://doi.org/10.1016/j.xcrm.2024.101512
合成生物學技術與腫瘤靶向細菌的整合極大地提高了細菌對腫瘤內部微環(huán)境或外部物理刺激的響應性能,使在體精準調控治療基因的表達成為可能。目前,研究者結合各種啟動子元件已開發(fā)了多種化學、物理和生物方法,以實現(xiàn)工程化細菌在腫瘤部位精準調控治療基因的表達。然而,利用靜脈注射化學誘導物存在毒副作用且難于靶向聚集腫瘤部位,群體感應誘導系統(tǒng)存在基因誘導時間不可控等問題;利用光控或聲控等物理刺激手段具有靶向精準刺激、時空分辨率高、開啟或關閉便捷等優(yōu)勢,但光控刺激存在組織穿透性不足,限制了其在深部腫瘤中的應用;相比之下,超聲具有高的組織穿透性,優(yōu)良的時空分辨率,不僅可以實時成像,還可以將聲波進行聚焦于深部腫瘤部位產(chǎn)生熱效應用于基因的表達調控。在之前的研究中(Nat Commun. 2022;13:4468),研究團隊開發(fā)了一種超聲響應性基因線路,將其整合到腫瘤靶向細菌實現(xiàn)了治療基因在腫瘤部位的時空可控表達,提高了細菌基因治療腫瘤的有效性和安全性。然而,由于細菌在腫瘤內部分布不均以及超聲焦點難于監(jiān)測,目前仍然無法可視化這些腫瘤內部的工程化細菌,并實現(xiàn)影像引導超聲精準定位腫瘤內細菌調控治療基因的表達。為此,嚴飛研究員團隊和陳智毅教授團隊研發(fā)了一種超聲可視化工程細菌(Ec@DIG-GVs),可在超聲成像引導下精準調控腫瘤內工程化細菌的基因表達,為腫瘤治療提供了一種新的策略。
研究團隊首先將聲學報告基因(ARG1)質粒和溫控基因線路(IFN-γ)質粒依次導入至大腸桿菌MG1655中,獲得了Ec@IG,接著在體外誘導Ec@IG內的聲學報告基因表達GVs獲得含生物納泡細菌Ec@IG-GVs。最后,利用化學修飾策略將阿霉素連接至Ec@IG-GVs表面制備獲得了超聲可視化的工程化細菌Ec@DIG-GVs。透射電鏡及相差顯微鏡結果證實Ec@DIG-GVs細菌內部表達了大量的生物納泡(GVs),免疫熒光標記和吸收光值測定表明阿霉素成功偶聯(lián)至細菌表面(圖1)。
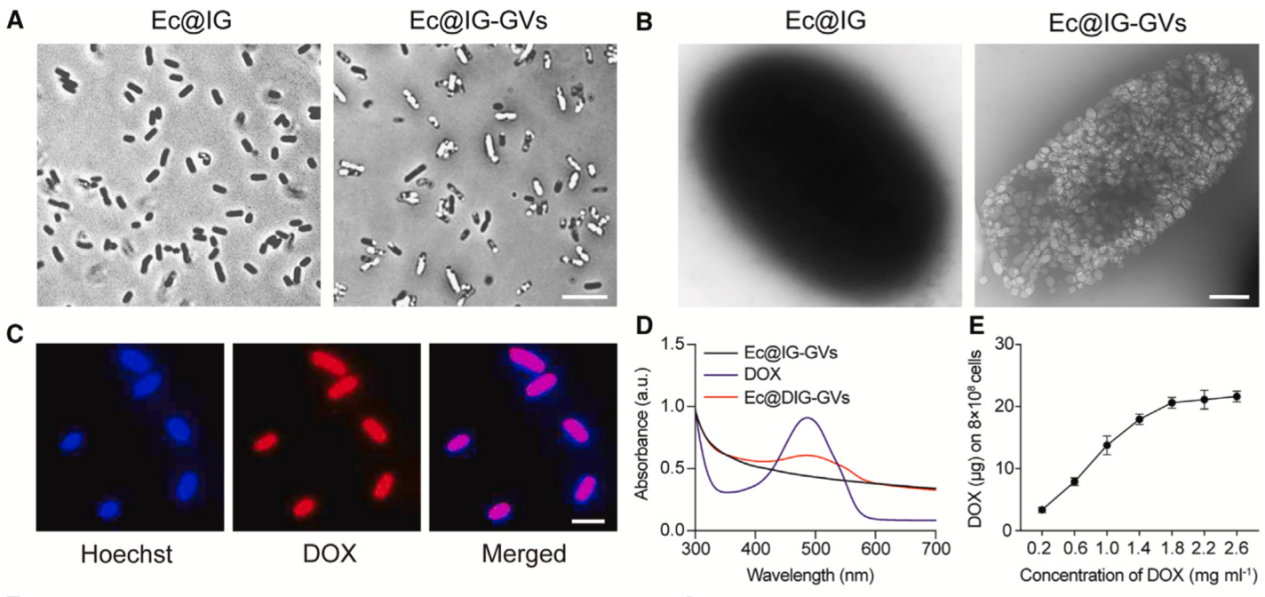
圖1. 超聲可視化細菌的制備
研究團隊進一步對Ec@DIG-GVs的各項功能進行了驗證。首先確認了含GVs的Ec@DIG-GVs具有超聲造影成像信號且具有濃度依賴性增強。同時,為了驗證超聲成像引導hHIFU刺激工程化細菌內溫控基因線路表達外源基因的可行性,研究團隊將Ec@IG-GVs中的IFN-γ基因替換為mCherry報告基因(Ec@MG-GVs),并將該細菌包埋至瓊脂凝膠內(上層為含泡細菌,下層為不含泡細菌),在超聲成像引導下將hHIFU焦點定位至Ec@MG-GVs處輻照25分鐘,結果顯示hHIFU輻照的區(qū)域由于GVs的爆破出現(xiàn)了超聲信號的消失,37°C放置6小時后發(fā)現(xiàn)僅僅接收hHIFU的區(qū)域出現(xiàn)了明顯的紅色熒光,表明工程化細菌可以實現(xiàn)超聲造影引導hHIFU定點誘導mCherry蛋白的表達。此外,通過將Ec@DIG-GVs置于不同pH值條件下,證實了DOX能夠實現(xiàn)酸響應性釋放并有效進入腫瘤細胞(圖2)。
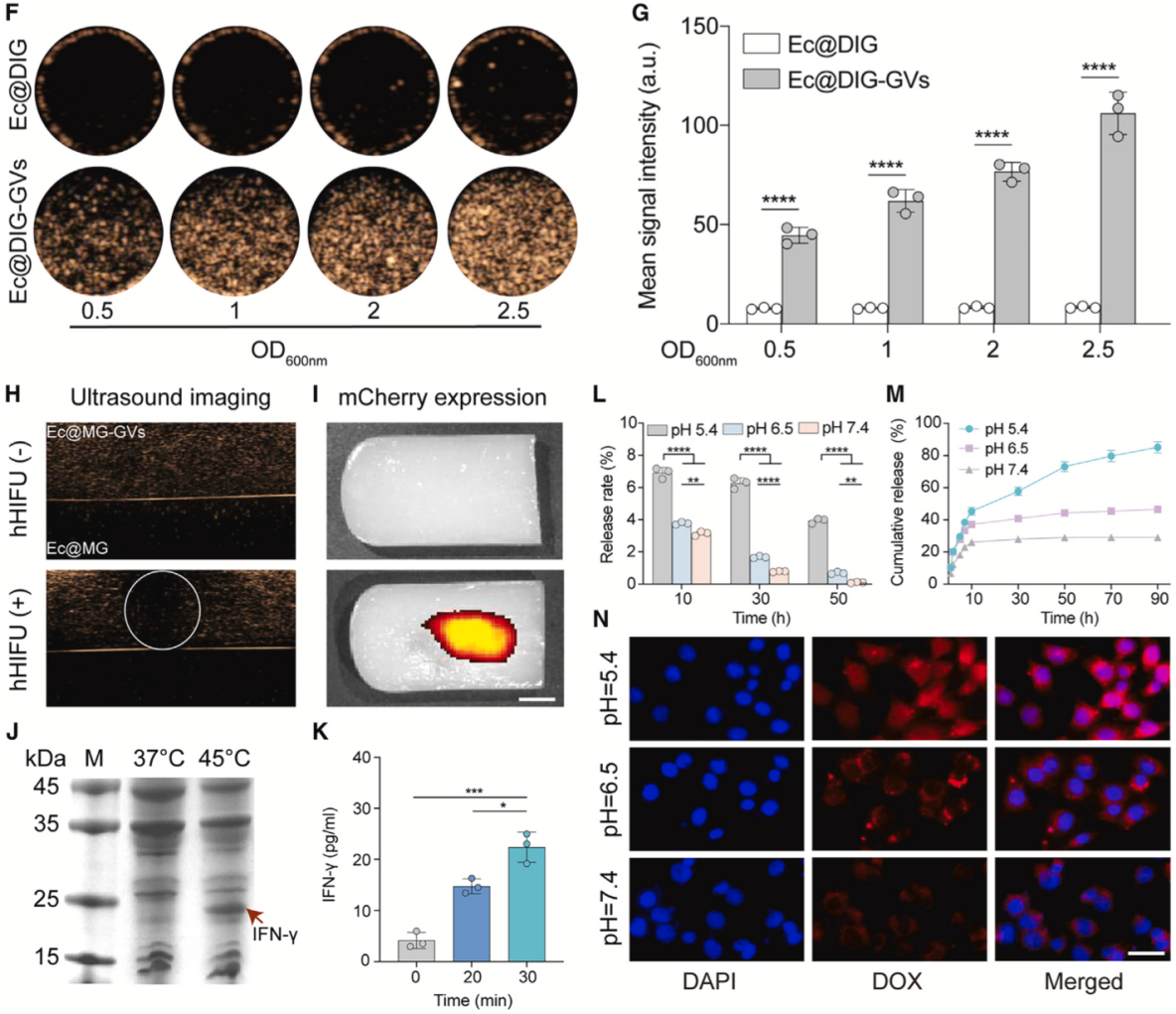
圖2. 超聲可視化細菌的功能表征
隨后,研究團隊測試了Ec@DIG-GVs的腫瘤細胞殺傷活性和免疫激活的情況,將Ec@DIG-GVs進行酸性處理并給予hHIFU輻照誘導IFN-γ的表達,離心去除細菌后獲得了含有DOX和IFN-γ的上清液。將該上清液與腫瘤細胞孵育后,可見腫瘤細胞發(fā)生明顯的凋亡和免疫原性死亡(CRT、HMGB1蛋白標志物的檢測)。將該上清液與巨噬細胞共孵育后發(fā)現(xiàn)M1型巨噬細胞占比明顯增加,說明Ec@DIG-GVs所釋放的IFN-γ和DOX具有殺傷腫瘤并能誘導M1型巨噬細胞極化(圖3)。
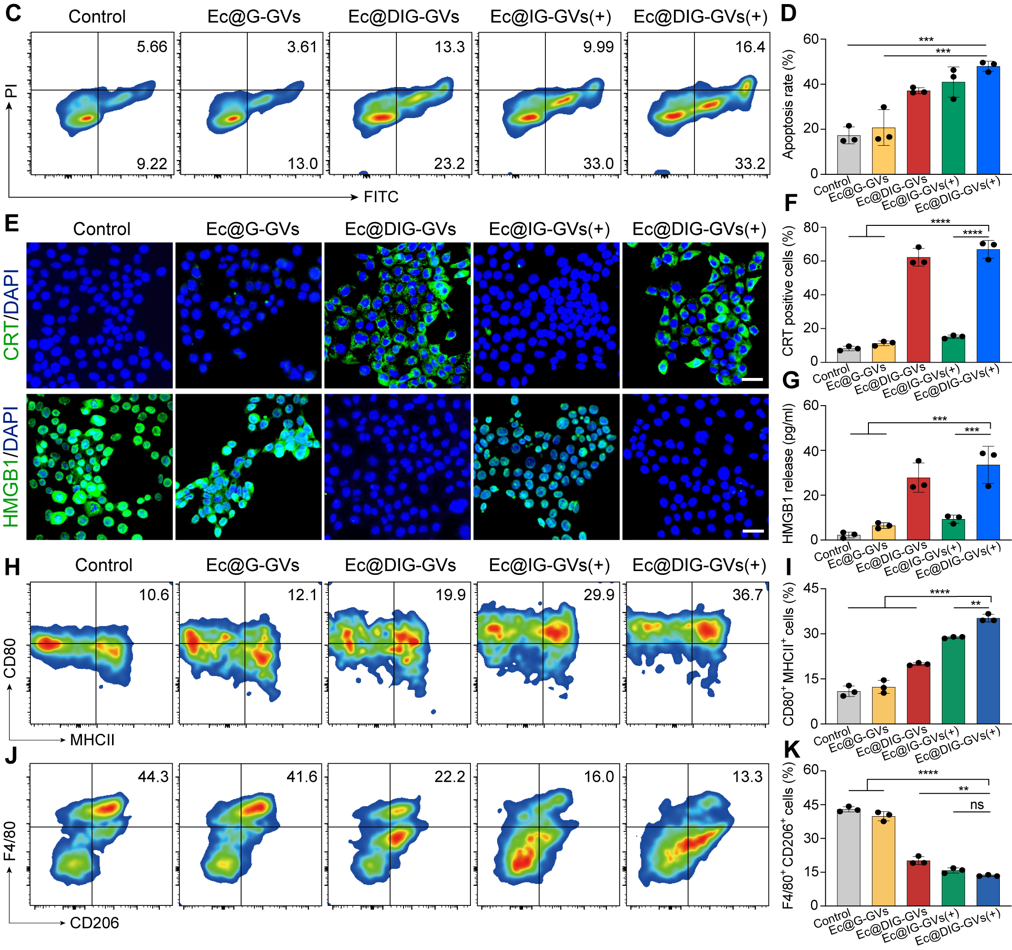
圖3. 超聲可視化細菌表達IFN-γ并釋放DOX殺傷腫瘤細胞并誘導巨噬細胞極化
接著研究團隊將該工程化細菌應用到荷瘤小鼠中,通過瘤內注射Ec@MG或Ec@MG-GVs,發(fā)現(xiàn)Ec@MG-GVs展現(xiàn)出良好的腫瘤內超聲成像能力,通過超聲成像定位腫瘤內細菌位置并引導hHIFU進行輻照。結果顯示在同一個腫瘤內僅僅經(jīng)過hHIFU輻照的區(qū)域超聲信號消失,4小時后輻照區(qū)有紅色熒光產(chǎn)生(mCherry蛋白表達),而未輻照區(qū)域無紅色熒光。切片結果顯示輻照區(qū)域所產(chǎn)生的紅色熒光呈近似圓形,能與hHIFU輻照焦點相對應。利用該方法進行超聲成像引導hHIFU輻照Ec@DIG-GVs進行腫瘤治療,腫瘤生長可以得到明顯的抑制,并延長荷瘤小鼠的生存期(圖4)。
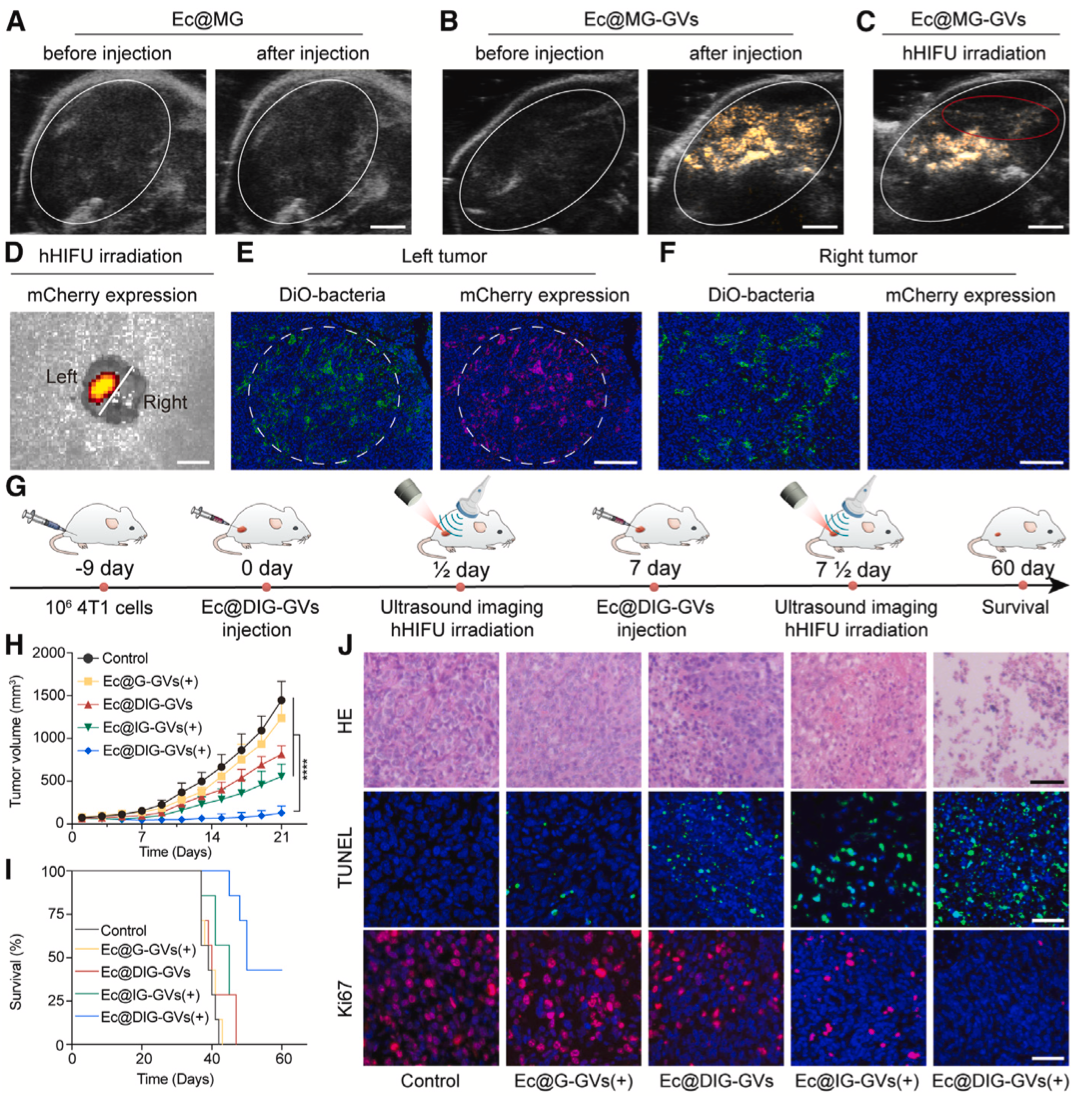
圖4. 瘤內注射超聲可視化細菌的抗腫瘤效果驗證
在確認瘤內注射工程化細菌聯(lián)合超聲輻照能取得較好的治療效果后,研究團隊進一步測試了該工程化細菌靜脈注射后的腫瘤靶向能力,為便于觀察,將ICG替換DOX修飾至Ec@IG-GVs表面獲得Ec@IIG-GVs,靜脈注射Ec@IIG-GVs后,腫瘤及各主要器官熒光成像結果表明Ec@IIG-GVs具有較好的腫瘤靶向聚集能力。重要的是,研究團隊發(fā)現(xiàn)靜脈注射Ec@IIG-GVs后,腫瘤內超聲成像信號隨時間逐漸增加,與熒光成像靶向驗證結果相一致(圖5),表明工程化細菌還可實現(xiàn)在腫瘤內的超聲成像示蹤。
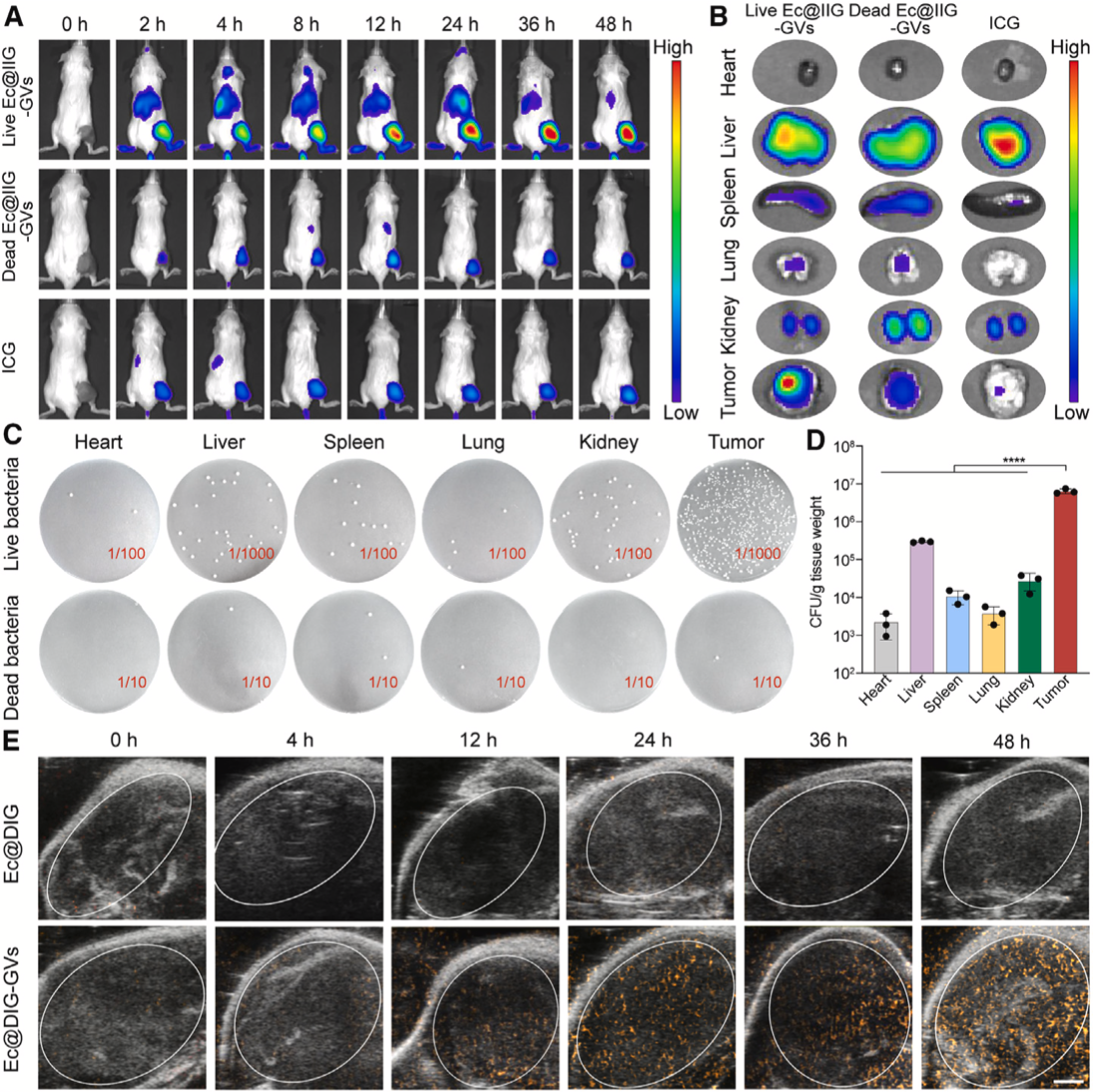
圖5 超聲可視化細菌的腫瘤靶向驗證
基于該工程細菌良好的腫瘤靶向性,研究團隊進一步檢測了靜脈注射Ec@DIG-GVs聯(lián)合超聲誘導IFN-γ基因表達治療腫瘤的效果,在靜脈注射Ec@DIG-GVs后,通過超聲成像確定工程化細菌到達腫瘤的時間和位置,引導hHIFU輻照誘導腫瘤內細菌IFN-γ的表達。結果表明,在IFN-γ和DOX的共同作用下,Ec@DIG-GVs+hHIFU處理組顯著抑制了腫瘤生長,延長了荷瘤小鼠生存時間,進一步的機制研究發(fā)現(xiàn)超聲成像引導hHIFU輻照Ec@DIG-GVs(Ec@DIG-GVs+hHIFU組)顯著不僅促進了腫瘤細胞的凋亡,還促進了腫瘤內DC細胞成熟,M2型巨噬細胞向M1型極化,有效激活了機體的抗腫瘤免疫效應(圖6)。
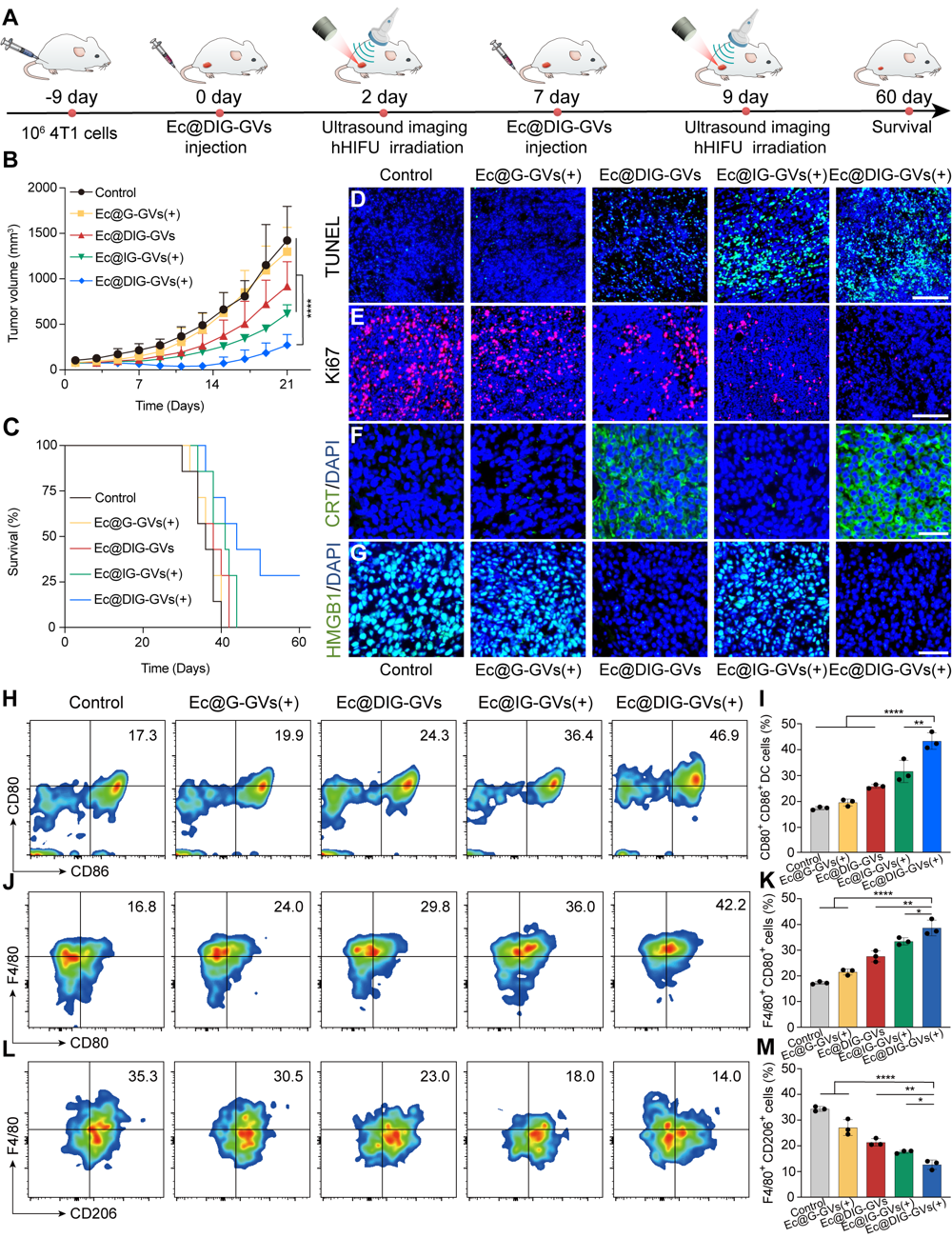
圖6. 靜脈注射超聲可視化細菌的抗腫瘤與免疫激活效應
該工作獲得了國家科技部重點研發(fā)計劃項目、國家自然科學基金面上項目及深圳合成生物學創(chuàng)新研究院等項目的支持。
參考文獻:
Yaozhang Yang;Yuanyuan Wang;Fengyi Zeng;Yuhao Chen;Zhiyi Chen;Fei Yan. Ultrasound-visible engineered bacteria for tumor chemo-immunotherapy. Cell reports medicine, 2024.
附件下載:


